1. LEER LOS TEMAS Y OBSERVAR LOS VIDEOS
2. EVALUACIÓN ya realizada
Ley de Boyle
Esta ley nos permite relacionar la presión y el volumen de un gas cuando la temperatura es constante.
La ley de Boyle (conocida también como de Boyle y Mariotte) establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante .
La ley de Boyle (conocida también como de Boyle y Mariotte) establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante .
Lo cual significa que:
El volumen de un gas es inversamente proporcional a la presión que se le aplica:
En otras palabras:
Si la presión aumenta, el volumen disminuye.
Si la presión disminuye, el volumen aumenta.
Esto nos conduce a que, si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor .
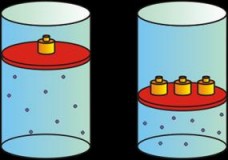 |
| Presión y volumen: si una sube, el otro baja. |
Matemáticamente esto es:
lo cual significa que el producto de la presión por el volumen es constante.
Para aclarar el concepto:
Tenemos un cierto volumen de gas (V 1 ) que se encuentra a una presión P 1 . Si variamos la presión a P 2 , el volumen de gas variará hasta un nuevo valor V 2 , y se cumplirá:
que es otra manera de expresar la ley de Boyle.
Apliquemos la fórmula en un ejemplo práctico:
Tenemos 4 L de un gas que están a 600 mmHg de presión. ¿Cuál será su volumen si aumentamos la presión hasta 800 mmHg? La temperatura es constante, no varía.
Solución:
Como los datos de presión están ambos en milímetros de mercurio (mmHg) no es necesario hacer la conversión a atmósferas (atm). Si solo uno de ellos estuviera en mmHg y el otro en atm, habría que dejar los dos en atm.
Aclarado esto, sustituimos los valores en la ecuación P 1 V 1 = P 2 V 2 .
Ponemos a la izquierda el miembro con la incógnita
Despejamos V 2 :
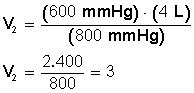
Respuesta:
Si aumentamos la presión hasta 800 mmHg el volumen disminuye hasta llegar a los 3 L.
Ley de Charles
Mediante esta ley relacionamos la temperatura y el volumen de un gas cuando mantenemos la presión constante.
Textualmente, la ley afirma que:
Textualmente, la ley afirma que:
El volumen de un gas es directamente proporcional a la temperatura del gas.
En otras palabras:
Si aumenta la temperatura aplicada al gas, el volumen del gas aumenta.
Si disminuye la temperatura aplicada al gas, el volumen del gas disminuye.
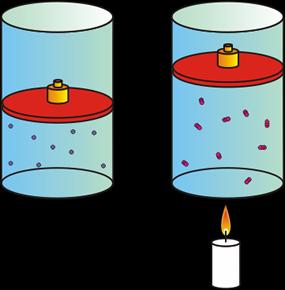 |
| A mayor temperatura, mayor volumen. |
Como lo descubrió Charles, si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen (V) y la temperatura (T) siempre tiene el mismo valor (K) (es constante).
Matemáticamente esto se expresa en la fórmula
lo cual significa que el cociente entre el volumen y la temperatura es constante.
Intentemos ejemplificar:
Supongamos que tenemos un cierto volumen de gas V 1 que se encuentra a una temperatura T 1 . Si aumentamos la temperatura a T 2 el volumen del gas aumentará hasta V 2 , y se cumplirá que:
que es otra manera de expresar la ley de Charles.
Veamos un ejemplo práctico y sencillo:
Un gas cuya temperatura llega a 25° C tiene un volumen de 2,5 L. Para experimentar, bajamos la temperatura a 10° C ¿Cuál será su nuevo volumen?
Solución:
El primer paso es recordar que en todas estas fórmulas referidas a la temperatura hay que usar siempre la escala Kelvin.
Por lo tanto, lo primero es expresar la temperatura en grados Kelvin:
Por lo tanto, lo primero es expresar la temperatura en grados Kelvin:
T 1 = (25 + 273) K= 298 K
T 2 = (10 + 273 ) K= 283 K
Ahora, sustituimos los datos en la ecuación:
Ahora, despejamos V 2 :
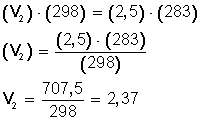
Respuesta:
Si bajamos la temperatura hasta los 10º C (283º K) el nuevo volumen del gas será 2,37 L.
Ley de Gay-Lussac
Esta ley establece la relación entre la presión (P) y la temperatura (T) de un gas cuando el volumen (V) se mantiene constante, y dice textualmente:
La presión del gas es directamente proporcional a su temperatura.
Esto significa que:
Si aumentamos la temperatura, aumentará la presión.
Si disminuimos la temperatura, disminuirá la presión.
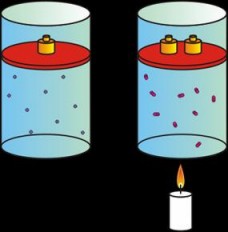 |
| A mayor temperatura, mayor presión. |
Si lo llevamos al plano matemático, esto queda demostrado con la siguiente ecuación:
la cual nos indica que el cociente entre la presión y la temperatura siempre tiene el mismo valor; es decir, es constante.
Llevemos esto a la práctica y supongamos que tenemos un gas, cuyo volumen (V) no varía, a una presión P 1 y a una temperatura T 1 . Para experimentar, variamos la temperatura hasta un nuevo valor T 2 , entonces la presión cambiará a P 2 , y tendrá que cumplirse la siguiente ecuación:
que es la misma Ley de Gay-Lussac expresada de otra forma.
Debemos recordar, además, que esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta, y tal como en la Ley de Charles, las temperaturas han de expresarse en grados Kelvin.
Veamos un ejemplo:
Tenemos un cierto volumen de un gas bajo una presión de 970 mmHg cuando su temperatura es de 25° C. ¿A qué temperatura deberá estar para que su presión sea 760 mmHg?
Solución:
Lo primero que debemos hacer es convertir los 25º C a grados Kelvin:
T 1 = (25 + 273) K= 298 K
Ahora sustituimos los datos en la ecuación:
Ahora despejamos T 2 :
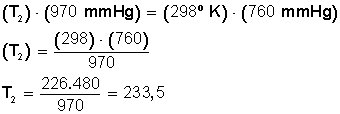
Respuesta:
La temperatura debe bajar hasta los 233,5º Kelvin. Si convertimos estos grados en grados Celsius hacemos
233,5 − 273 = −39,5 °C.
233,5 − 273 = −39,5 °C.


